急性呼吸窮迫症候群(ARDS)とは
急性呼吸窮迫症候群(きゅうせいこきゅうきゅうはくしょうこうぐん:Acute Respiratory Distress Syndrome(以下ARDS))とは、重症肺炎、敗血症や外傷などの様々な疾患が原因となり重度の呼吸不全となる症状の総称です。
重症肺炎、敗血症や外傷などによって、炎症性細胞が活性化され、肺の組織である肺胞や毛細血管に傷害を与えます。その結果、肺に水がたまり、重度の呼吸不全が引き起こされます。
ARDSは一般的に、原因となる疾患や外傷が発生してから24~48時間以内に発生すると言われています。また、発症後の死亡率は全体の30~58%※1とも言われており、極めて予後が悪い疾患です。
日本におけるARDS患者数は28,000人程度全世界では110万人超と推定されます※2。
- ※1 出典:ARDS診療ガイドライン2016
- ※2 日本で推定されるARDSの人数は、疫学データの発症率と人口統計の総合人口を基に当社推定。
全世界は、下記の米欧中の統計を合算。
米国:Diamond M et al. 2023 Feb 6. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–.PMID: 28613773
欧州:Community Research and Development Information Service (CORDIS) 2020 7-9
中国:song-et-al-2014-acute-respiratory-distress-syndrome-emergingresearch-in-china
現在の治療法
ARDSに対する治療として、集中治療室で気管チューブやマスクを使った人工呼吸管理による呼吸不全に対する治療が行われます。ただ、人工呼吸器の使用が長期化すると、患者の予後が悪くなることが知られています。また薬物療法も行われますが、現時点において、ARDSを発症した際の生命予後を直接改善できる治療薬はありません。そのため、症状や生命予後の改善につながる新規の治療法の開発が望まれています。
ヘリオスが目指すARDSに対する新規細胞治療法
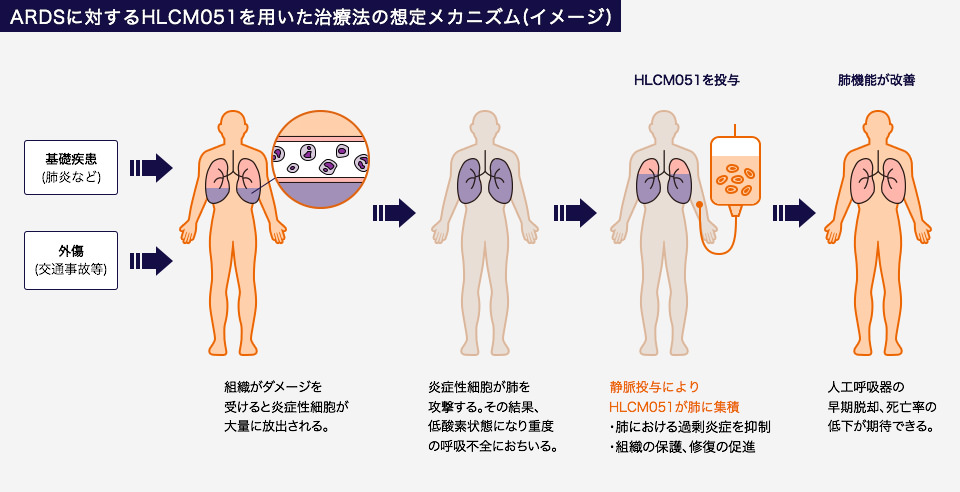
当社は、アサシス社が創製した幹細胞製品MultiStem®(HLCM051)を用いた全世界での権利を保有し、新規の細胞治療法を開発しています。
この細胞治療法は、ARDSと診断された患者さんにHLCM051 を一定の時間内に静脈投与するものです。
ARDSを発症した患者さんに静脈投与されたHLCM051は、肺に集積して過剰炎症を抑制し、さらに損傷を受けた組織を保護し、修復を促進することで肺機能を改善すると考えられます。これらの作用により、人工呼吸器からの早期脱却、死亡率の低下などが期待されています。
アサシス社は、欧米においてARDS患者に対するMultiStem®の安全性と有効性を探索する第Ⅰ/Ⅱ相試験を実施し、2019年1月にその結果速報を発表しました。当該試験により、ARDS患者に対するMultiStem®の安全性及び忍容性は良好であることが確認されました。また、プラセボ対照二重盲検試験として実施された第Ⅱa相試験では、死亡率、28日間のうち人工呼吸器を使用しなかった日数及び28日間のうちICU管理が不要であった日数、といった指標において、MultiStem®投与群に改善傾向が見られました。
当社は、日本国内において、肺炎を原因疾患とするARDSを適応疾患とした有効性及び安全性を検討する第Ⅱ相試験(治験名:ONE-BRIDGE 試験)を実施し、HLCM051投与後90日と180日の評価項目のデータを解析した結果、良好な結果が示されたため、2022年3月末に独立行政法人医薬品医療機器総合機構(PMDA)と承認申請に向けての相談を実施しました。現在、国内での追加治験を開始し、グローバルでの治験について検討中です。
本治験の情報は、米国国立医学図書館が管理するウェブサイト”ClinicalTrials.gov”に登録・公開しています。(Identifier: NCT03807804)
